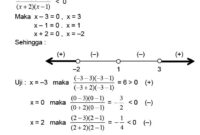
Contoh Soal Sel Volta
Sel volta, juga dikenal sebagai sel galvani, adalah perangkat elektrokimia yang mengonversi energi kimia menjadi energi listrik. Prinsip kerjanya bergantung pada reaksi redoks spontan antara dua elektroda yang dicelupkan ke dalam larutan elektrolit.
Contoh Soal 1
Sebuah sel volta terdiri dari elektroda seng (Zn) dan elektroda tembaga (Cu). Elektroda seng dicelupkan ke dalam larutan seng sulfat (ZnSO4), sedangkan elektroda tembaga dicelupkan ke dalam larutan tembaga sulfat (CuSO4).
Tulislah reaksi redoks yang terjadi dalam sel dan hitung potensial sel.
Jawaban:
Reaksi redoks:
Zn(s) → Zn²⁺(aq) + 2 e⁻
Cu²⁺(aq) + 2 e⁻ → Cu(s)
Potensial elektroda standar:
E°(Zn²⁺/Zn) = -0,76 V
E°(Cu²⁺/Cu) = +0,34 V
Potensial sel:
E°(sel) = E°(katoda) – E°(anoda)
E°(sel) = +0,34 V – (-0,76 V)
E°(sel) = +1,10 V
Contoh Soal 2
Sebuah sel volta dibuat menggunakan elektroda besi (Fe) dan elektroda perak (Ag). Elektroda besi dicelupkan ke dalam larutan besi(II) sulfat (FeSO4), sedangkan elektroda perak dicelupkan ke dalam larutan perak nitrat (AgNO3).
Hitunglah konsentrasi ion besi(II) dalam larutan FeSO4 jika potensial sel yang diukur adalah +0,86 V.
Jawaban:
Persamaan Nernst:
E(sel) = E°(sel) – (RT/nF) ln(Q)
+0,86 V = +1,28 V – (0,0592 V/mol)(298 K)/(2 mol) ln([Fe²⁺])
Sehingga,
ln([Fe²⁺]) = -7,25
[Fe²⁺] = 10⁻⁷,²⁵ M
Contoh Soal 3
Sebuah sel volta disusun dengan elektroda hidrogen (H2/H⁺) dan elektroda klorin (Cl2/Cl⁻). Tekanan gas hidrogen adalah 1 atm, dan konsentrasi ion klorida adalah 0,1 M.
Hitunglah potensial sel pada suhu 298 K.
Jawaban:
Persamaan Nernst:
E(sel) = E°(sel) – (RT/nF) ln(Q)
E°(sel) = +1,36 V (potensial sel standar)
Q = [Cl⁻]/[H⁺]¹/² = 10⁻⁰,¹
Sehingga,
E(sel) = +1,36 V – (0,0592 V/mol)(298 K)/(2 mol) ln(10⁻⁰,¹)
E(sel) = +1,40 V
Sampai jumpa kembali di artikel menarik lainnya!